Антиген представляющий т и в лимфоциты
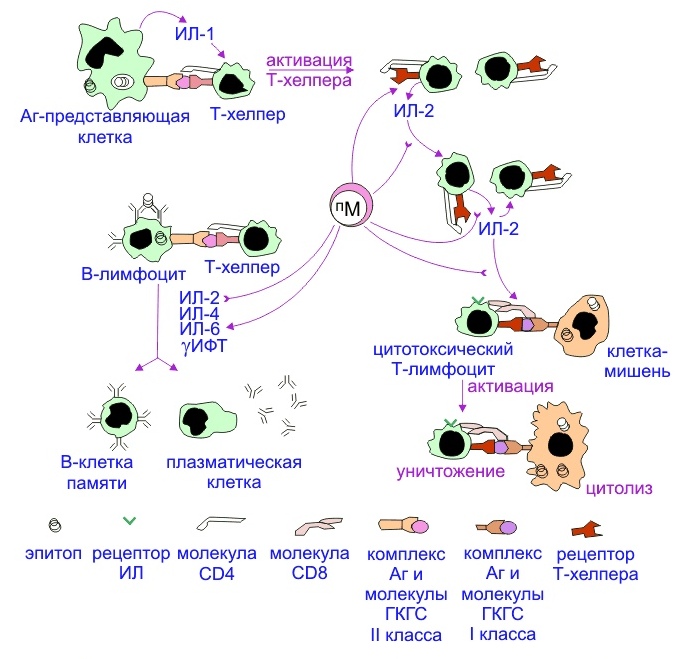
Важнейшим этапом развития специфического клеточного иммунного ответа является активация популяции Т-лимфоцитов. Однако эти клетки не могут самостоятельно распознать попавший в организм чужеродный агент и начать выполнять свои функции. Для активации Т-лимфоциту нужны специальные помощники — антигенпрезентирующие клетки (АПК), которые представляют фрагмент чужеродного материала на своей поверхности в составе с главным комплексом гистосовместимости второго класса (MHC II).
MHC II представляют собой особые молекулы, к которым специфичны поверхностные рецепторы Т-хелперов.
Понятие об антигенпрезентирующих клетках
АПК относятся к вспомогательным клеткам иммунной системы. Среди них есть “профессионалы”, которые умеют “включать” в работу нативные Т-хелперы, не только презентируя антиген, но и производя индуцирующий сигнал при контакте. Активированные Т-лимфоциты приобретают способность распознавать чужеродные фрагменты на мембранных поверхностях не только АПК, но и всех других клеток, способных к презентации. Однако в последнем случае антиген представляется в составе МНС I, а не II.
Нативные же Т-хелперы, ни разу не контактировавшие с чужеродными агентами, могут взаимодействовать только с комплексом антиген-МНС II, который формируется исключительно у АПК. Таким образом, антигенпрезентирующие клетки иммунной системы — клетки, способные экспрессировать на поверхность молекулы главного комплекса гистосовместимости именно второго класса.
Популяция АПК — это гетерогенная группа лейкоцитов, обладающих выраженными иммуностимулирующими свойствами. К ней относят несколько типов клеток, которые способны поглощать чужеродные агенты путем фаго- или эндоцитоза и выставлять их на поверхности в составе рецепторов, которые могут быть распознаны Т-хелперами при контакте. Последние же запускают целый каскад реакций иммунного ответа, что подчеркивает важность АПК.

Функционирование АПК
Функция антигенпрезентирующих клеток заключается не только в презентации, но и в индукции специфического сигнала, который при контакте активирует нативную Т-клетку, еще ни разу не встречавшуюся с антигеном.
Работа АПК состоит из двух этапов:
- процессинг — рестрикция молекулы антигена на мелкие фрагменты;
- презентация — встраивание антигенного пептида в MHC и экспортирование образовавшегося комплекса на мембранную поверхность.
Большая часть АПК образуется в костном мозге.
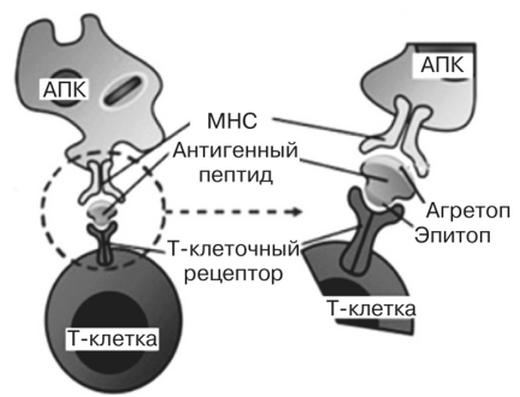
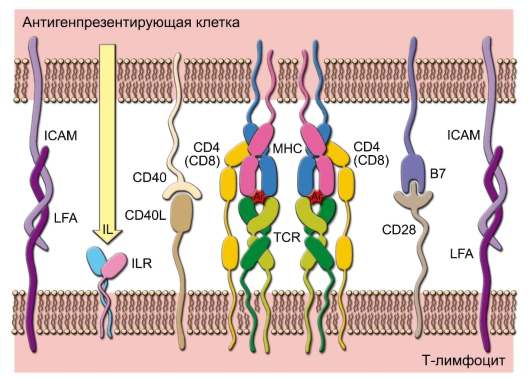
При контакте антигенпрезентирующей клетки с Т-лимфоцитом рецепторы последнего распознают видоизмененную встраиванием чужеродного пептида молекулу MHC. При этом осуществляется эффект костимуляции.
Какие клетки считают антигенпрезентирующими
В иммунологии антигенпрезентирующими клетками считаются клетки, которые способны:
- экспрессировать на мембранной поверхности молекулы MHC второго класса;
- индуцировать стимулирующий сигнал для популяции Т-лимфоцитов.
Особенно важным критерием является презентация антигена именно в комплексе с MHC II, который может быть распознан Т-хелпером. Процессировать чужеродную молекулу в составе MHC 1 способны практически все клетки, однако их не называют антигенпрезентирующими.
Разновидности АПК
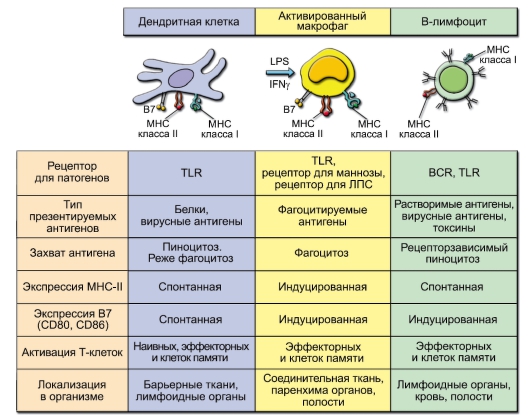
В иммунологии антигенпрезентирующие клетки подразделяются на две большие группы: профессиональные и непрофессиональные.
К профессиональным АПК относят:
- макрофаги;
- дендритные клетки;
- В-клетки.
Популяция дендритных клеток весьма обширна и подразделяется на:
- белые отросчатые эпидермоциты (клетки Лангерганса);
- интердигитальные клетки тимуса;
- фолликулярные дентритные клетки (ФДК).
Все специализированные АПК обладают способностью доставлять костимуляторные сигналы нативным Т-лимфоцитам, что называется функцией сенсибилизации.
Непрофессиональными АПК считаются:
- клетки мозговой глии;
- клетки эпителия тимуса и щитовидной железы;
- эндотелиальные сосудистые клетки;
- бета-клетки поджелудочной железы;
- кожные фибробласты.
Неспециализированные АПК способны образовывать и экскретировать комплексы антиген-MHC II только после стимуляции цитокинами, в качестве которых могут выступать интерферон-гамма и другие вещества.
Локализация и миграция АПК в организме
Антигенпрезентирующие клетки расположены преимущественно в:
- коже;
- лимфоузлах;
- тимусе;
- эпителии и субэпителиальном слое большинства слизистых оболочек.
АПК, сосредоточенные в эпидермисе, называются клетками Лангерганса. После представления антигена на поверхности в комплексе с MHC они мигрируют в региональные лимфатические узлы, где взаимодействуют Т-лимфоцитами. Перемещение АПК Лангерганса осуществляется по афферентным лимфатическим сосудам.
Особая популяция фолликулярных дентритных клеток (ФДК), ответственная за презентацию антигенов В-лимфоцитам, сосредоточена в лимфоидной ткани слизистых оболочек и в фолликулах лимфатических узлов.
Особенность ФДК заключается в том, что они не мигрируют в ответ на инфекцию, а постоянно находятся в составе стабильной сети, образованной собственными отростками, которые соединяются друг с другом посредством десмосом.
Механизм представления антигена
Как уже было отмечено выше, презентации антигена предшествует процессинг. Вначале антигенпрезентирующая клетка поглощает чужеродный агент путем фагоцитоза или эндоцитоза. Затем в специальных органеллах (фагосомах или протеосомах) с помощью ферментов происходит разрезание антигенных белков на небольшие фрагменты длиной 8-12 аминокислотных остатков.
Экзогенные пептиды, попадающие в АПК, являются продуктами переваривания фагоцитов. В антигенпрезентирующей клетке осуществляется их дальнейшая рестрикция на более мелкие пептиды. Эндогенные пептиды процессируются в протеосомах.
Затем происходит соединение фрагмента антигена с главным комплексом гистосовместимости. В пространственной конформации молекулы MHC есть специальная полость, куда и помещается чужеродный пептид. Образовавшийся комплекс антиген-MHC транспортируется на поверхность мембраны АПК.
Источник
Т-клетки это фактически приобретенный иммунитет, способный защитить от цитотоксического повреждающего воздействия на организм. Чужеродные клетки-агрессоры, попадая в организм вносят “хаос”, который внешне проявляется в симптомах заболеваний.
Клетки-агрессоры повреждают по ходу своей деятельности в организме все, что могут, действуя в своих интересах. А задача иммунной системы найти и уничтожить все чуждые элементы.
Специфическая защита организма от биологической агрессии (чужеродных молекул, клеток, токсинов, бактерий, вирусов, грибов и т.д.) осуществляется при помощи двух механизмов:
- продуцирования специфических антител в ответ на чужеродные антигены (потенциально опасных для организма веществ);
- выработки клеточных факторов приобретённого иммунитета (Т-клетки).
Как осуществляются иммунные реакции
При попадании в организм человека «клетки-агрессора», иммунная система распознаёт чужеродные и собственные измененные макромолекулы (антигены) и удаляет их из организма. Также при первичном контакте с новыми антигенами происходит их запоминание, что способствует их более быстрому удалению, в случае вторичного попадания в организм.
Процесс запоминания (презентация) происходит благодаря антиген-распознающим рецепторам клеток и работе антиген представляющих молекул (МНС молекул- комплексов гистосовместимости).
Что такое Т-клетки иммунной системы, и какие функции они выполняют
Функционирование иммунной системы обуславливается работой лимфоцитов. Это клетки иммунной системы, являющиеся
разновидностью лейкоцитов и способствующие формированию приобретённого иммунитета. Среди них выделяют:
- В-клетки (распознающие «агрессора» и вырабатывающие к нему антитела);
- Т-клетки (выполняющие функцию регулятора клеточного иммунитета);
- NК- клетки (разрушающие отмеченные антителами чужеродные структуры).
Однако, помимо регуляции иммунного ответа, Т-лимфоциты способны выполнять эффекторную функцию, разрушая опухолевые, мутировавшие и чужеродные клетки, участвовать в формировании иммунологической памяти, распознавать антигены и индуцировать иммунные реакции.
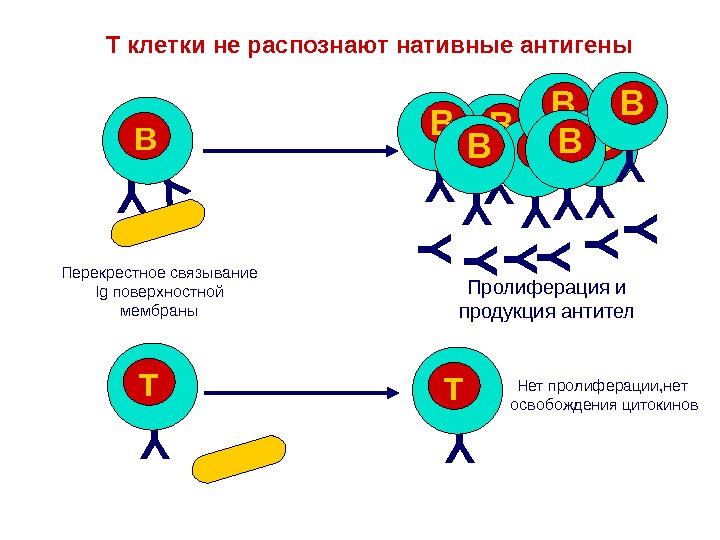
Справочно. Важной особенностью T-клеток является их способность реагировать только на презентированные антигены. На одном T-лимфоците находится только один рецептор к одному конкретному антигену. Это обеспечивает отсутствие реакции T-клеток на собственные аутоантигены организма.
Разнообразие функций Т-лимфоцитов обусловлено наличием в них субпопуляций, представленных Т-хелперами, Т-киллерами и Т-супрессорами.
Субпопуляция клеток, их стадия дифференцирования (развития), степень зрелости и т.д. определяется при помощи специальных кластеров дифференцировки, обозначаемых как СD. Наиболее значимыми являются СD3, СD4 и СD8:
- СD3 находится на всех зрелых T-лимфоцитах, он способствует передаче сигнала от рецептора к цитоплазме. Это важный маркер функционирования лимфоцитов.
- СD8 – это маркер цитотоксических T-клеток.
- СD4 является маркером T-хелперов и рецептором к ВИЧ (вирус иммунодефицита человека)
Т-хелперы
Около половины Т-лимфоцитов имеют антиген CD4, то есть являются Т-хелперами. Это помощники, стимулирующие процесс секреции антител В-лимфоцитами, стимулируют работу моноцитов, тучных клеток и предшественников Т-киллеров к «включению» в иммунную реакцию.
Справочно. Функция хелперов осуществляется за счёт синтеза цитокинов (информационных молекул, регулирующих взаимодействие между клетками).
В зависимости от продуцируемого цитокина, их разделяют на:
- T-хелперные клетки 1-го класса (продуцируют интерлейкин-2 и гамма-интерферон, обеспечивая гуморальный иммунный ответ на вирусы, бактерии, опухоли и трансплантанты).
- T-хелперные клетки 2-го класса (секретируют интерлейкины-4,-5,-10,-13 и отвечают за образование IgЕ, а также иммунного ответа, направленного на внеклеточные бактерии).
Т-хелперы 1-го и 2-го типа всегда взаимодействуют антагонистически, то есть повышенная активность первого типа угнетает функцию второго типа и наоборот.
Работа хелперов обеспечивает взаимодействие между всеми клетками иммунитета, определяя какой тип иммунного ответа будет преобладать (клеточный либо гуморальный).
Важно. Нарушение работы клеток-помощников, а именно недостаточность их функции, наблюдается у больных с приобретённым иммунодефицитом. Т-хелперы являются основной мишенью ВИЧ. В результате их гибели нарушается иммунная реакция организма на стимуляцию антигенов, что приводит к развитию тяжёлых инфекций, росту онкологических новообразований и летальному исходу.
Т-киллеры
Это так называемые T-эффекторы (цитотоксические клетки) или клетки убийцы. Такое название обусловлено их способностью уничтожать клетки-мишени. Осуществляя лизирование (ли́зис (от греч. λύσις — разделение) — растворение клеток и их систем) мишеней, переносящих чужеродный антиген или мутировавший аутоантиген (трансплантанты, опухолевые клетки), они обеспечивают реакции противоопухолевой защиты, трансплантационного и противовирусного иммунитета, а также аутоиммунные реакции.
Т-киллеры при помощи собственных МНС-молекул распознают чужеродный антиген. Связываясь с ним на поверхности клетки, они продуцируют перфорин (цитотоксический белок).
После лизирования клетки «агрессора» Т-киллеры остаются жизнеспособными и продолжают циркулировать в крови, разрушая чужеродные антигены.
Т-киллеры составляют до 25-ти процентов от всех Т-лимфоциотов.
Справочно. Помимо обеспечения реакций нормального иммунного ответа, Т-эффекторы могут участвовать в реакциях антителозависимой клеточной цитотоксичности, способствуя развитию гиперчувствительности второго типа (цитотоксической).
Это может проявляться лекарственными аллергиями и различными аутоиммунными заболеваниями (системные заболевания соединительной ткани, гемолитическая анемия аутоиммунного характера, злокачественная миастения, аутоиммунные тиреоидиты, и т.д.).
Подобным механизмом действия обладают некоторые лекарственные средства, способные запускать процессы некроза опухолевых клеток.
Важно. Препараты с цитотоксическим действием используют в химиотерапии онкологических заболеваний.
Например, к таким медикаментам относится Хлорбутин. Это средство применяют для лечения хронического лимфолейкоза, лимфогранулематоза и рака яичников.
Т-супрессоры и клетки памяти
Супрессоры подавляют функцию хелперов и В-лимфоцитарного звена. Однако современная классификация не выносит супрессоры в отдельную субпопуляцию. Поскольку доказано, что решающую роль в угнетении иммунной реакции играют апоптоз и специфические цитокины.
Помимо основных T-лимфоцитов, в организме человека существуют потомки клеток, контактировавших с антигеном и имеющих к нему рецепторы. Это клетки обеспечивающие иммунологическую память. Они способны в течение от десяти до 15 лет сохранять память об антигене, передавая её другим клеткам.
Справочно. Благодаря клеткам памяти обеспечивается быстрый иммунный ответ при повторном попадании «агрессора» в организм.
Нулевые лимфоциты
К ним относят лимфоциты, не имеющие T и B маркеров. Они составляют до 10% от всей популяции лимфоцитов. К ним относят NК-клетки (естественные киллеры) и K-клетки (киллерные).
Справочно. Основным отличием NK-клеток от T-киллеров является способность уничтожать не сенсибиллизированные клетки-мишени.
K-клетки отвечают за антителозависимую клеточную цитотоксичность. Они отражают взаимодействия гуморального и клеточного звеньев иммунитета, а также выступают в качестве «наводчиков» эффекторных (выполняющих функцию – в данном случае уничтожение) клеток на мишень.
NК- клетки обеспечивают контроль за качеством клеток и участвуют в формировании противовирусного иммунитета, обеспечиваютзащиту от роста опухолей и размножения мутировавших (дефектных) клеток.
Диагностика клеточного иммунитета
Диагностика T- и B-лимфоцитарного звена позволяет оценить состояние клеточного иммунитета. Базовое исследование с определением процентного содержания Т-, В- и нулевых клеток проводится с целью выявления первичных или вторичных иммунодефицитов, а также при контроле иммуностимулирующего лечения.
Исследование основных популяций при помощи маркеров CD3, 8, 19, 16+5б, а также соотношение между хелперами и киллерами, позволяет комплексно оценить иммунный статус. Для исследования используют венозную кровь.
Диагностика проводится при выявлении и контроле течения:
- аутоиммунных заболеваний (увеличено содержание CD3, CD4 хелперов);
- лимфолейкозов (повышено количество Т-лимфоцитов CD3);
- злокачественных новообразований (увеличено количество NK);
- ВИЧ (CD3, CD8);
- хронических инфекций, аллергических реакций, бронхиальной астмы и т.д.
Справочно. В зависимости от результатов анализа пациенту может быть рекомендована консультация иммунолога, гематолога, аллерголога, онколога или инфекциониста. С дальнейшим лечением у профильного специалиста по основному заболеванию.
Источник
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Пандемия COVID-19 продолжается и усиливается. Все больше людей в мире встречается с данным вирусом. Уже давно стало понятно, что SARS-CoV-2 не исчезнет из человеческой популяции. Вероятность встречи с ним возрастает для каждого.
Тем не менее, многие люди, неоднократно и длительно контактировавшие с заболевшими COVID-19 – сами не заболевают, никаких клинических симптомов не появляется. Почему так происходит – один из самых насущных вопросов на всех уровнях попыток понимания текущей пандемии, от бытового до научно-медицинского.
Наиболее вероятный ответ на него – особенности иммунного ответа части населения. В предыдущих публикациях описывались варианты протекания инфекционного процесса при COVID-19, механизмы и сроки антителообразования В-лимфоцитами, с учетом того, что известно про эту инфекцию на данном этапе ее изучения. Однако, «не антителами едиными жив наш иммунитет…». В механизмах специфического иммунного ответа на патогены выделяют гуморальный иммунный ответ (опосредуемый присутствующими в плазме крови антителами) и клеточный иммунный ответ (опосредуемый клетками иммунной системы без участия антител). Клеточное звено иммунной системы (прежде всего, Т-клеточное звено) также играет немаловажную роль в появлении резистентности макроорганизма к той или иной инфекции. Как «вырисовывается» понимание – к COVID-19 тоже.
Т-клеточное звено состоит из различных пулов Т-лимфоцитов (обозначаемых общепринятой в иммунологии для указания их характерных маркеров аббревиатурой CD и цифрой/числом – CD-3, CD-4, CD-8, CD-16 и другие). Если ОЧЕНЬ упрощенно, то основные задачи Т-клеточного звена:
Опознать и изучить антиген – передать информацию о нем другим звеньям иммунной системы – уничтожить антиген – запомнить его.
У части людей, в силу особенностей иммунитета (а также, видимо, при инфицировании низкой дозой возбудителя), Т-клеточное звено элиминирует вирус из организма без значимой активации В-клеточного звена, то есть – с низким уровнем антителообразования, нередко не детектируемым (не определяемым) рутинными лабораторными методами. При этом, клинических симптомов часто не развивается. Иными словами, человек может перенести инфекционный процесс без развития болезни, уровень антител у него не определяется, но организм приобретает защиту от повторного заражения. Насколько стойкую и долгую – вопрос остается открытым.
Однако, недавние, достаточно объемные исследования группы ученых из нескольких стран выявили:
- Образование устойчивого Т-клеточного ответа на SARS-CoV-2 у большинства пациентов, встречавшихся с данным вирусом
- При этом у части пациентов, никогда не встречавшихся с SARS-CoV-2 – уже имеются Т-лимфоциты, реагирующие на данный вирус и элиминирующие его из организма.
До конца данный феномен пока не изучен, но наиболее вероятной является теория о том, что Т-лимфоциты у данных пациентов перекрестно активированы предыдущим воздействием широко циркулирующих в популяции «простудных» коронавирусов.
Подробнее –
здесь.
То есть: у части людей есть приобретенная невосприимчивость к SARS-CoV-2, обусловленная, вероятнее всего Т-клетками, которые ранее «активировались» другими коронавирусами и сохранили иммунологическую память.
Данное утверждение сложно проверить массовым лабораторным скринингом. Изучение Т-клеточного ответа к инфекциям – достаточно трудоемкий процесс и чаще удел специализированных научно-исследовательских лабораторий. Однако, уже опубликованные результаты и продолжающиеся работы по изучению Т-клеточного иммунитета при COVID-19 – дают определенную почву для осторожного оптимизма.
А.С. Поздняков, к.м.н.,
инфекционист, главный врач ООО «Инвитро-Сибирь»
Статистика INVITRO по пациентам с выявленными антителами к коронавирусу
Анализы для выявления антител в организме
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Информация проверена экспертом

Лишова Екатерина Александровна
Высшее медицинское образование, опыт работы – 19 лет
Источник