Активация т и в лимфоцитов
Адаптивный иммунный ответ начинается с презентации антигена — встречи наивного Т-лимфоцита со своим уникальным антигеном. В результате клетка интенсивно делится — ведь в предстоящей борьбе из всех миллионов лимфоцитов будет участвовать только активированный клон (клоны), и её потомство дифференцируется в вооруженные эффекторные клетки. Однако презентации антигена недостаточно для активации Т-лимфоцита. Без дополнительной стимуляции презентация антигена приводит к апоптозу, анергии или развитию Т-регуляторных клеток. Такая реакция является защитой от аутоиммунного ответа: активация антигенного рецептора в отсутствие воспаления скорее всего означает, что клон аутореактивный. Однако такое возможно и при иммуносупрессии, например, вызванной опухолью. В таком случае иммунная толерантность играет против организма. Молекулярные механизмы тонкого контроля активации Т-лимфоцитов являются сегодня областью активного изучения.
Активация Т-клеточного рецептора
Т-клеточный рецептор (TCR), состоящий из двух цепей α и β, является тем самым рецептором, распознающим антиген и делающим каждый клон лимфоцитов уникальным. Однако сами по себе эти две цепи не активируют лимфоцит и даже не являются рецептором в строгом смысле слова, потому что не могут передавать сигнал внутрь клетки. Они являются частью рецепторного комплекса и только в сочетании с несколькими инвариантными компонентами обеспечивают сигнальную функцию. Инвариантные части рецептора: CD3 комплекс (CD3γ, CD3δ, CD3ε цепи) и ζ цепи — содержат ITAMs (immunoreceptor tyrosine-based activation motifs), фосфорилирование тирозиновых остатков в которых и инициирует весь сигнальный каскад после распознавания антигена. Наконец, еще одним необходимым компонентом являются ко-рецепторы – CD4 или CD8, которые распознают MHC II и MHC I соответственно. Они стабилизируют взаимодействие антигенного рецептора и комплекса «пептид–МНС», которое иначе может быть очень непрочным и недостаточно продолжительным для активации рецептора из-за низкой аффинности.
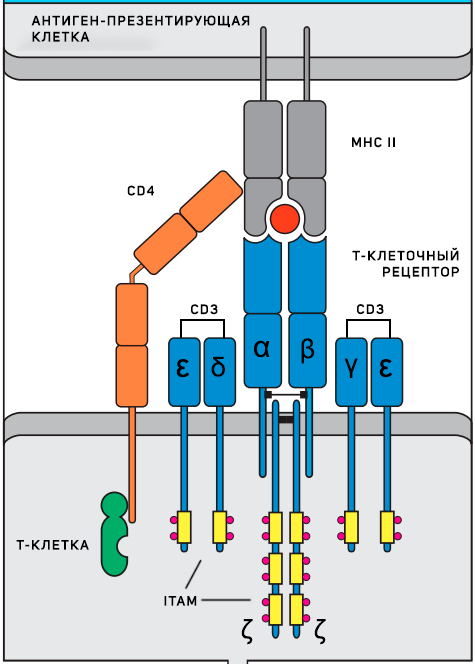
Схема Т-клеточного рецептора
Активацию Т-лимфоцита составляют несколько основных сигнальных путей:
- Активация фосфолипазы C-γ приводит к изменениям в транскрипции (экспрессия генов эффекторных клеток: гранзимы и цитокины и др.).
- Активация серин/треониновой киназы Akt активирует метаболизм (обеспечение процессов синтеза и пролиферации).
- Адапторный протеин ADAP усиливает адгезию (стабилизация контакта между Т-клеткой и антиген-презентирующей клеткой (АПК)). Клетки, лишённые ADAP активируются слабо, т.е. без без дополнительной адгезии контакт непрочный и недостаточный.
- Активация белка Vav приводит к изменениям в цитоскелете (формирование иммунного синапса — прочного контакта между Т-клеткой и АПК/В-клеткой/клеткой-мишенью).
Сигналинг от фосфолипазы С делится в свою очередь на три ветви:
- Выход кальция в цитоплазму активирует транскрипционный фактор NFAT (nuclear factor of activated T cells), который перемещается в ядро и активирует многие гены, необходимые для активации Т-лимфоцитов. NFAT настолько важен для иммунного ответа, что ингибиторы этого сигнального пути широко используются для предотвращения отторжения трансплантатов.
- Активация Ras запускает сигнальный путь MAPK и, в итоге, экспрессию транскрипционного фактора АР-1.
- Активация протеинкиназы C-θ (изоформа протеинкиназы С, встречающая только в Т-клетках и мышцах) активирует транскрипционные факторы NFκB.
Эффекты Akt:
- Антиапоптотический.
- Экспрессия рецепторов хоуминга и адгезии.
- Активация метаболизма, в т.ч. через активацию сигнального пути mTOR, который повышает скорость синтеза белков и липидов [1].
В активированной клетке повышается потребление железа, аминокислот и глюкозы и интенсивность гликолиза, что переводит ее в приоритетное положение для организма. Нарушение в процессах активации метаболизма приводят к дисфункции Т-лимфоцитов, например, при сепсисе. Это может быть частично компенсировано применением ИЛ-7 [2].
Ко-стимуляция
Сигналинг через TCR необходим, но недостаточен для активации Т-лимфоцита. Этот сигнал называют сигнал 1, а для активации необходимо сочетание сигнала 1 и сигнала 2. Рецепторы, в сочетании с TCR обеспечивающие активацию Т-лимфоцита, называют ко-стимулирующие рецепторы — сигнал 2. Антиген-презентирующие клетки несут на своей поверхности ко-стимулирующие лиганды. Для активации Т-клетка должна связаться с антигеном и ко-стимулирующим лигандом (сигнал 1 и сигнал 2) на одной и той же АПК. Эта мера необходима для того, чтобы активация происходила, только когда она действительно нужна. Отсутствие ко-стимуляции говорит об отсутствии воспаления, что скорее всего означает, что произошло узнавание собственного антигена, и иммунный ответ не запускается.
Главным рецептором Т-лимфоцитов является CD28, его несут все наивные Т-лимфоциты. Лигандами CD28 на АПК являются B7.1 (CD80) и B7.2 (CD86). Связывание CD28 с лигандами приводит к активации фосфолипазы С, Akt и Vav, т.е. усиливает большинство эффектов TCR сигналинга. Все они возможны только при сочетании двух сигналов. Рецепторы семейства TNF (OX40, 4-1BB, CD30, and CD27) — главные ко-стимулирующие рецепторы В-лимфоцитов – активируют Akt и NFκB. Кроме того, в качестве стимуляции может выступить непосредственное взаимодействие патогена с распознающими рецепторами такими, как TLR. Следует отметить, что концепция ко-стимуляции пересматривается и расширяется в настоящее время в связи с открытием новых ко-стимулирующих рецепторов, осуществляющих свои функции через разные механизмы. Показано, что ко-стимуляция, например через рецептор GITR, помимо помощи TCR сигналингу, участвует в определении судьбы Т-клетки [3]. Возможно, продолжающаяся стимуляция может вносить вклад в истощение Т-лимфоцитов [4].
Огромный интерес ко-стимулирующие рецепторы вызывают в области иммунотерапии рака, а именно адоптивной терапии, особенно после того, как было показано, что ко-стимуляции in vitro может быть достаточно, а значит можно избежать негативных эффектов системного применения [5]. Некоторые ко-стимулирующие рецепторы, такие как GITR, сейчас подтверждают свою эффективность в исследованиях с химерными антигенными рецепторами и могут быть в скором времени использованы в иммунотерапии в качестве дополнительного стимулирующего домена в составе химерного рецептора [6]. Кроме того, ингибиторы ко-стимулирующих рецепторов могут лечь в основу новых безопасных и эффективных методов терапии иммунных отторжений трасплантатов [7].
ICOS (inducible T-cell co-stimulator) — член семейства рецепторов CD28 — другой важный ко-стимулирующий рецептор. Сейчас он активно рассматривается в контексте лечения реакции “трансплантат-против-хозяина” [8]. А в иммунотерапии рака клинические испытания в настоящее время проходят и агонисты, и антагонисты этого рецептора [9]. Дело в том, что помимо усиления противоопухолевого Т-клеточного ответа, данный рецептор может активировать Т-регуляторные клетки и, следовательно, вносить вклад в иммуносупрессию. Ко-стимулирующий рецептор CD46 усиливает активацию CD8+ клеток и их развитие в цитотоксические Т-лимфоциты. Однако этот же рецептор угнетает продукцию IFN-γ Т-хелперами и индуцирует их развитие в регуляторные Т-клетки [10].
Ко-стимулирующие рецепторы критически важны для адекватного иммунного ответа. Так, недостаток ICOS вызывает иммунодефициты с широким спектром клинических проявлений, включая повышенную предрасположенность к инфекционным заболеваниям и злокачественным опухолям [11]. Баланс экспрессии ко-стимуляторных и ко-ингибиторных рецепторов на Т-лимфоцитах изменяется уже на ранних этапах развития опухолей, подчеркивая важность иммунного надзора и необходимость иммуносупрессии для формирования и прогрессии опухоли [12].
Ингибирование
Ингибиторные рецепторы контролируют развитие иммунного ответа и являются необходимым регулятором иммунного гомеостаза. Основные ингибиторные рецепторы относятся к тому же семейству, что и CD28, наиболее изученные включают CTLA-4 (CD152), PD-1 (programmed death-1), BTLA (B and T lymphocyte attenuator), TIGIT (T cell Ig and ITIM domain), TIM-3, LAG-3, CD96, среди последних открытых — PDPN, PROCR [13].
CTLA-4 хранится на внутриклеточных мембранах и перемещается на поверхность клетки, когда активируется антигенный рецептор. CTLA-4 связывает те же лиганды, что и CD28, но с более высокой аффинностью, и ингибируют тем самым сигнал 2. Другие ингибиторные рецепторы содержат ITIMs (immunoreceptor tyrosine-based inhibitory motif) и активируют внутриклеточные фосфатазы. Поскольку значительная часть сигналинга через TCR опосредована тирозинкиназами, фосфатазы ингибируют их эффекты. К таким рецепторам традиционно относят PD-1. Однако, недавние исследования показывают, что основной механизм действия — это дефосфорилирование CD-28 и, следовательно, нарушение ко-стимуляции [14]. Лиганды PD-1 экспрессируются самыми разнообразными клетками (PD-L1) или исключительно АПК (PD-L2). PD-1 экспрессируется на активированных Т-лимфоцитах и составляет важную петлю обратной связи, контролирующую экспансию лимфоцитов.
Ингибиторные рецепторы Т-лимфоцитов привлекают огромное внимание в контексте рака. Терапия, направленная на ингибирование данных рецепторов, носит название immune checkpoint blockade. Разнообразие ингибирующих рецепторов является одной из причин ее неэффективности. Так, было показано, что экспрессия Tim-3 может вызывать резистентность к блокаде PD-L1 [15]. Важную роль в ингибировании Т-лимфоцитов сегодня отводят интерлейкину 27. Именно он может стимулировать экспрессию ко-ингибиторных рецепторов и «помечать» таким образом Т-клетки для истощения. Стимуляции трех ко-ингибиторных рецепторов достаточно для того, чтобы Т-клетка стала дисфункциональной [13].
Антитела, блокирующие ингибиторные рецепторы и их лиганды, уже получили распространение в терапии опухолей (меланома, НМРЛ и др.). Однако сейчас огромный интерес вызывает перспектива сочетания традиционных видов терапии — радио- и химиотерапии с иммунотерапевтическими подходами. С одной стороны, уже понятно, что эффекты радио- и химиотерапии во многом опосредованы иммунными процессами. С другой стороны, гибель клеток в результате применения традиционных методов может сделать опухоль «горячей» — активно инфильтрированной иммунными клетками — и повысить эффективность иммунотерапии. Эффективность полимодальной терапии подверждается все новыми доклиническими исследованиями: иммунорадиотерапия + блокада PD-L1 [16].
Таким образом, активация Т-лимфоцитов требует тонкой регуляции, которая достигается балансом ко-стимулирующих и ингибиторных рецепторов. Недостаточная активация снижает эффективность иммунного ответа против инфекционных агентов и опухолевых клеток, чрезмерная активация приводит к аутоиммунным заболеваниям. Наши представления о процессах активации и ко-стимуляции Т-лимфоцитов до сих пор активно развиваются. Открытия в этой области проложат путь к новым возможностям терапии рака, аутоиммунных заболеваний и отторжения органов в трансплантологии.
Источники:
- Simon-Molas, Helga, et al. “PI3K–Akt signaling controls PFKFB3 expression during human T-lymphocyte activation.” Molecular and cellular biochemistry (2018): 1-11.
- Venet, Fabienne, et al. “IL-7 restores T lymphocyte immunometabolic failure in septic shock patients through mTOR activation.” The Journal of Immunology (2017): ji1700127.
- Cobbold, Stephen P., et al. “CD4+ T cell fate decisions are stochastic, precede cell division, depend on GITR co-stimulation, and are associated with uropodium development.” bioRxiv (2018): 298026.
- Ozkazanc, Didem, et al. “Functional exhaustion of CD4+ T cells induced by co‐stimulatory signals from myeloid leukaemia cells.” Immunology 149.4 (2016): 460-471.
- Pham Minh, Ngoc, et al. “In vivo antitumor function of tumor antigen‐specific CTLs generated in the presence of OX40 co‐stimulation in vitro.” International journal of cancer 142.11 (2018): 2335-2343.
- Golubovskaya, V. M., et al. “GITR domain inside CAR co-stimulates activity of CAR-T cells against cancer.” Frontiers in bioscience (Landmark edition) 23 (2018): 2245-2254.
- Herr, Florence, et al. “Co-stimulation blockade plus T-cell depletion in transplant patients: towards a steroid-and calcineurin inhibitor-free future?.” Drugs 76.17 (2016): 1589-1600.
- Zhang, Mengmeng, et al. “ICOS impacts chronic Graft-versus-Host Disease by regulating both pathogenic and regulatory T cells.” Frontiers in immunology 9 (2018): 1461.
- Amatore, Florent, Laurent Gorvel, and Daniel Olive. “Inducible Co-Stimulator (ICOS) as a potential therapeutic target for anti-cancer therapy.” Expert opinion on therapeutic targets 22.4 (2018): 343-351.
- Hansen, Aida S., et al. “CD46 is a potent co-stimulatory receptor for expansion of human IFN-γ-producing CD8+ T cells.” Immunology letters (2018).
- Schepp, Johanna, et al. “14 Years after Discovery: clinical Follow-up on 15 Patients with inducible co-stimulator Deficiency.” Frontiers in immunology 8 (2017): 964.
- Rutkowski, Jacek, et al. “Evaluation of peripheral blood T lymphocyte surface activation markers and transcription factors in patients with early stage non-small cell lung cancer.” Cellular immunology 322 (2017): 26-33.
- Chihara, Norio, et al. “Induction and transcriptional regulation of the co-inhibitory gene module in T cells.” Nature 558.7710 (2018): 454-459.
- O’donnell, Jake S., Mark J. Smyth, and Michele WL Teng. “PD1 functions by inhibiting CD28‐mediated co‐stimulation.” Clinical & translational immunology 6.5 (2017): e138.
- Avery, Lyndsay, et al. “Tim-3 co-stimulation promotes short-lived effector T cells, restricts memory precursors, and is dispensable for T cell exhaustion.” Proceedings of the National Academy of Sciences 115.10 (2018): 2455-2460.
- Zhuang, Yuan, et al. “PD-1 blockade enhances radio-immunotherapy efficacy in murine tumor models.” Journal of cancer research and clinical oncology (2018): 1-12.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
Оглавление темы “Селезенка. Лимфатические узлы. Стадии иммунного ответа. Формы иммунного ответа. Воспаление. Механизмы, контролирующие иммунную систему.”: Активация Т- и В-лимфоцитов в иммунном ответе. Активация лимфоцитов. Формы специфического иммунного ответа.Передача сигнала активации от антигенраспознающего рецептора в ядро клетки приводит к активации конкретных генов, ответственных за митотическую активность клеток, контролирующих продукцию клеткой биологически активных молекул, участвующих в антимикробной защите (антитела, цитокины).
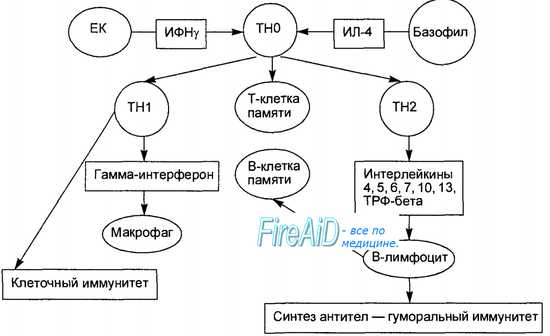
В-лимфоцит получает одновременно два сигнала активации: от антигенраспознающего рецептора при его соединении с антигеном и от связывания его поверхностных костимулирующих молекул с соответствующими лигандами на Т-лимфоцитах. После этого В-лимфоцит пролиферирует и потомки его превращаются в зрелые антителопродуцирующие плазматические клетки. Т-лимфоцит в ответ на контакт с антигеном начинает пролиферировать, потомки его приобретают способность продуцировать определенные цитокины или превращаются в зрелые цитотоксические клетки. В зависимости от того, какие дополнительные сигналы активации (цитокины, костимулирующие молекулы) получает Т-лимфоцит в момент контакта с антигеном, его потомки дифференцируются в двух разных направлениях, превращаясь в Т-хелперы, продуцирующие гамма-интерферон (Th1), или в Т-хелперы, продуцирующие интерлейкины-4, -5, -6, -10, -13 (Th2). Количественное преобладание Thl над Th2 является условием развития клеточного (кле-точно-опосредованного) иммунного ответа. В случае преобладания Th2 развивается гуморальный иммунный ответ, проявляющийся продукцией специфических антител (рис. 8.9). – Также рекомендуем “Клеточный иммунный ответ. Гуморальный иммунный ответ. Защитные функции иммуноглобулинов ( антител ).” |
Источник
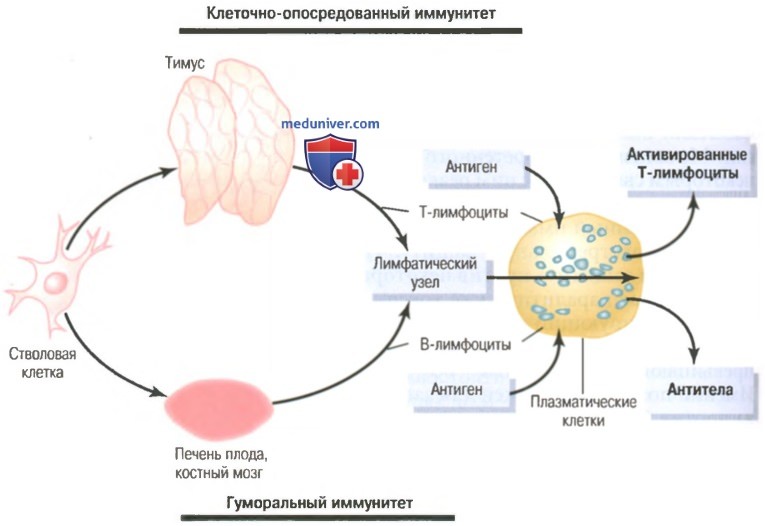
Т-лимфоциты и В-лимфоциты иммунитета. Предварительная обработка Т- и В-лимфоцитова) Клеточно-опосредованный и гуморальный иммунитеты обеспечивают два типа лимфоцитов – Т- и В-лимфоциты. Хотя при исследовании под микроскопом большинство лимфоцитов в нормальной лимфоидной ткани выглядят одинаковыми, эти клетки подразделяют на две основные популяции. Одна популяция — Т-лимфоциты — ответственна за формирование активированных лимфоцитов, обеспечивающих клеточно-опосредованный иммунитет. Другая популяция — В-лимфоциты — ответственна за формирование антител, обеспечивающих гуморальный иммунитет. Оба типа лимфоцитов образуются у эмбриона из полипотентных гемопоэтических стволовых клеток, формирующих лимфоциты как один из наиболее важных результатов их дифференцировки. Почти все сформированные лимфоциты в результате заселяют лимфоидную ткань, однако прежде чем это произойдет, они дополнительно дифференцируются или проходят предварительную обработку. Лимфоциты, которые в итоге станут активированными Т-лимфоцитами, сначала мигрируют к тимусу, где подвергаются предварительной обработке. Эти ответственные за клеточно-опо-средованный иммунитет лимфоциты называют Т-лимфоцитами, что подчеркивает роль тимуса. Другая популяция лимфоцитов, В-лимфоциты, предназначенные для формирования антител, проходят предварительную обработку в печени плода в середине периода внутриутробной жизни, а также в костном мозге в конце внутриутробной жизни плода и после рождения. Эта популяция клеток впервые была открыта у птиц, имеющих специальный орган для их предварительной обработки, который называют бурсой Фабриция (фабрициевой сумкой). Ответственные за гуморальный иммунитет лимфоциты называют В-лимфоцитами, что подчеркивает роль бурсы. На рисунке ниже показаны две лимфоцитарные системы для формирования: (1) активированных Т-лимфоцитов; (2) антител.
Предварительная обработка Т- и В-лимфоцитовВсе лимфоциты организма происходят от коммитированных в лимфоцитарном направлении стволовых клеток эмбриона, но эти клетки не могут непосредственно превратиться в активированные Т-лимфоциты или антитела. Прежде чем это станет возможным, клетки должны подвергнуться дальнейшей дифференцировке в соответствующих областях, где они проходят специфическую обработку. а) Т-лимфоциты проходят предварительную обработку в тимусе (вилочковой железе). После образования в костном мозге Т-лимфоциты сначала мигрируют к вилочковой железе. Здесь они быстро делятся, одновременно становясь чрезвычайно разнообразными, т.е. предназначенными для реакции против разных специфических антигенов. Это значит, что один лимфоцит, обработанный в тимусе, проявляет специфическую реактивность в отношении одного антигена. Следующий лимфоцит специфически реагирует на другой антиген. Это продолжается до тех пор, пока в тимусе не появятся тысячи разных типов лимфоцитов со специфической реактивностью в отношении тысяч разных антигенов. Эти разные типы предварительно обработанных Т-лимфоцитов оставляют тимус и распространяются кровью по всему телу, временно оседая в лимфоидной ткани. Кроме того, благодаря обработке в тимусе любой оставляющий его Т-лимфоцит не реагирует с белками или другими антигенами собственных тканей организма (иначе Т-лимфоциты погубили бы собственное тело человека в течение всего нескольких дней). Тимус выбирает, какие Т-лимфоциты могут его покинуть, сначала смешивая их практически со всеми специфическими аутоантигенами собственных тканей тела. Если Т-лимфоцит реагирует, он разрушается и фагоцитируется, вместо того, чтобы выделяться. Это происходит с основной частью клеток (вплоть до 90%). Таким образом, клетки, выделяющиеся из тимуса, не реагируют против собственных антигенов тела; они реагируют лишь на антигены внешних источников, например бактерий, токсинов или тканей, пересаженных от другого человека. Основная часть предобработки Т-лимфоцитов в тимусе происходит перед рождением ребенка и в течение нескольких месяцев после рождения. Удаление вилочковой железы после этого периода ослабляет (но не исключает) Т-лимфоцитарную иммунную систему. Однако удаление тимуса за несколько месяцев до рождения может нарушить развитие всего клеточно-опосредован-ного иммунитета. Поскольку именно клеточный тип иммунитета в основном отвечает за отторжение трансплантированных органов, например сердца или почек, органы можно пересаживать с меньшей вероятностью отторжения, если у животного в соответствующее время до его рождения удалить тимус. б) В-лимфоциты проходят предварительную обработку в печени и костном мозге. О деталях предварительной обработки В-лимфоцитов известно гораздо меньше, чем о предобработке Т-лимфоцитов. Известно, что у человека предварительная обработка В-лимфоцитов осуществляется в печени в середине внутриутробного периода развития, а также в костном мозге в конце внутриутробного периода и после рождения. Существуют два важных различия между В- и Т-лимфоцитами. Во-первых, В-лимфоциты активно секретируют реактивные агенты, называемые антителами, в отличие от Т-лимфоцитов, реагирующих с антигеном непосредственно. Антитела — это крупные белковые молекулы, способные соединяться с антигенной субстанцией и разрушать ее. Во-вторых, разнообразие В-лимфоцитов выражено больше, чем у Т-лимфоцитов, т.е. формируются миллионы типов В-лимфоцитарных антител с разными специфическими реактивностями. После предобработки В-лимфоциты, как и Т-лимфоциты, мигрируют к лимфоидной ткани по всему телу, где временно располагаются рядом, но несколько обособленно от областей локализации Т-лимфоцитов. – Также рекомендуем “Роль лимфоцитарных клонов. Происхождение клонов лимфоцитов” Оглавление темы “Клетки иммунитета. Виды иммунитета”: |
Источник